 |
- Galeria Zdrowia, Marketingu i Rozrywki -
Public Relations - kursy i szkolenia - oferty terapeutyczne
|
| Zobacz poprzedni temat :: Zobacz następny temat |
| Autor |
Wiadomość |
admin
Administrator
Dołączył: 23 Kwi 2006
Posty: 299
Przeczytał: 0 tematów
Pomógł: 5 razy
Ostrzeżeń: 0/3
|
 Wysłany: Wto 12:00, 10 Lis 2020 Temat postu: Infekcje górnych dróg oddechowych Wysłany: Wto 12:00, 10 Lis 2020 Temat postu: Infekcje górnych dróg oddechowych |
|
|
.
Większość ostrych zakażeń górnych dróg oddechowych ma etiologię wirusową.
2020-11-08
ANNA ZAWADZKA-GRALEC

Medycyna zna niewiele chorób, w których stosuje się tak wiele nieskutecznych metod leczenia,
jak ma to miejsce w wirusowych zakażeniach górnych dróg oddechowych.
Prof. John G. Barlett
Ostre infekcje górnych dróg oddechowych charakteryzuje sezonowość z wyraźnym wzrostem częstości występowania w okresie jesienno-zimowym, gdyż typowe dla jesieni zmiany warunków pogodowych sprzyjają szerzeniu się zakażeń wirusowych [1,2].
W chłodnej porze roku, przy temperaturach poniżej 10°C, zwiększa się aktywność drobnoustrojów, a obniża się sprawność aparatu śluzowo-rzęskowego odpowiedzialnego za oczyszczenie, nawilżenie i ogrzanie wdychanego powietrza [3].
Ryzyko zakażenia dróg oddechowych można postrzegać jako wypadkową oddziaływania warunków atmosferycznych, ogólnego stanu zdrowia oraz aktualnej wydolności mechanizmów odporności nieswoistej i swoistej organizmu, a także obecności w środowisku czynników infekcyjnych i ich bieżącej aktywności oraz stabilności, co zilustrowano na rycinie 1.
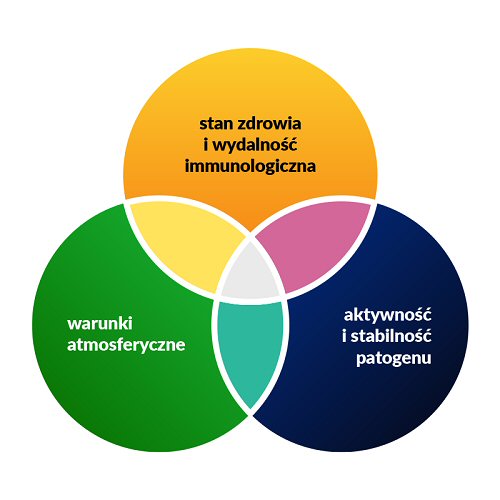
Rycina 1. Czynniki wpływające na prawdopodobieństwo wystąpienia zakażenia górnych dróg oddechowych.
Większość ostrych zakażeń górnych dróg oddechowych ma etiologię wirusową. Szacuje się, że rhinopharyngitis jest spowodowanych przez rynowirusy, orbiwirusy, paramyksowirusy, wirusy RS, wirusy grypy i paragrypy oraz adenowirusy [4].
Zakażenia wirusowe szerzą się głównie drogą powietrzno-kropelkową, stąd łatwo rozprzestrzeniają się w najbliższym otoczeniu osoby zakażonej - wśród członków rodziny i współpracowników.
Chorują osoby w każdym wieku. Infekcje są częstą przyczyną absencji szkolnej dzieci i młodzieży oraz - jak wskazują dane z aktualnego piśmiennictwa - istotną przyczyną niezdolności do pracy.
Według danych statystycznych w III kwartale 2016 roku stanowiły one około 38% liczby dni absencji chorobowej z powodu zakażeń układu oddechowego [5].
W przypadku zakażenia wirusem grypy lub wirusem RS dysponujemy leczeniem przyczynowym, a w odniesieniu do pozostałych zakażeń dróg oddechowych terapia ma charakter objawowy [6].
Znajomość patomechanizmu choroby sprzyja skuteczności i bezpieczeństwu każdej terapii. W przypadku ostrych zakażeń wirusowych górnych dróg oddechowych pojawienie się objawów chorobowych jest wynikiem cytopatycznego działania wirusa na komórki nabłonka oraz uruchomienia odpowiedzi immunologicznej.
Błona śluzowa górnych dróg oddechowych jest narażona na stały kontakt z różnymi antygenami obecnymi we wdychanym powietrzu i dzięki wyjątkowemu systemowi obrony NALT (ang. nasal associated lymphoid tissues) ma zdolność do szybkiej reakcji immunologicznej, której celem jest eliminacja patogenu i utrzymanie czynności dróg oddechowych.
System NALT tworzą makrofagi i komórki dendrytyczne, a także naiwne limfocyty T zdolne do przejścia w efektorowe Th1 i Th2 oraz limfocyty Treg, limfocyty T cytotoksyczne i Th17. Ponadto w NALT obecne są limfocyty B, wśród których znajdują się komórki zdolne do produkcji sekrecyjnych immunoglobulin klasy A i M.
We wczesnej fazie odpowiedzi immunologicznej ważną funkcję pełnią również bariery anatomiczne i biochemiczne, interferony typu I , komórki NK, komórki dendrytyczne, deaminazy cytydyny, infalmasom oraz teteryny [7].
Zainicjowanie reakcji obronnej jest możliwe dzięki zdolności rozpoznawania struktur molekularnych właściwych wyłącznie patogenom przez ludzkie komórki immunokompetentne za pomocą receptorów rozpoznających wzorce PRR (ang. pattern recognition receptors) obecnych na powierzchni lub w cytoplazmie makrofagów, monocytów i neutrofilów, komórek dendrytycznych fibroblastów oraz komórek błon śluzowych i śródbłonka naczyń.
Receptory PRR biorą udział nie tylko w rozpoznawaniu patogenów, ale także w ich eliminacji poprzez wydzielanie -defenzyn, ułatwianie fagocytozy, działanie chemotaktyczne oraz umożliwienie endocytozy patogenu do wnętrza komórek prezentujących antygen APC (ang. antigen presenting cells), jego proteolizę i ekspresję na powierzchni APC.
Tak opracowane fragmenty wirusa zostają zaprezentowane w regionalnych węzłach chłonnych limfocytom, co zapoczątkowuje odpowiedź swoistą (nabytą w trakcie życia) skierowaną przeciwko konkretnemu patogenowi [8].
Uruchomiona odpowiedź immunologiczna skutkuje złożoną reakcją enzymatyczną na poziomie komórkowym, w wyniku której dochodzi do aktywacji kaskady kwasu arachidonowego, uwalniania histaminy z mastocytów i powstawania aktywnych kinin.
Zarówno czynnik infekcyjny, jak i uwolnione kininy pobudzają neutrofile (główne komórki wczesnej fazy zapalenia) do fagocytozy i produkcji aktywnych metabolitów oraz syntezy interleukin (IL). Interleukina 1 jest niezbędna w procesie dojrzewania czynnościowego limfocytów T, a IL-2 pobudza wzrost limfocytów T cytotoksycznych, przez co pośrednio aktywuje apoptozę komórek zainfekowanych wirusami.
Uwolnione w trakcie kaskady odpowiedzi immunologicznej reaktywne formy tlenu przyczyniają się do zwiększenia poziomu jądrowych czynników transkrypcyjnych dla kolejnych cytokin zapalnych.
Zachodzące reakcje immunologiczne i - będące ich konsekwencją - procesy biochemiczne prowadzą do pojawienia się dobrze znanych z codziennej praktyki lekarskiej klinicznych objawów zapalenia: przekrwienia i obrzęku błony śluzowej górnych dróg oddechowych, wzrostu temperatury ciała oraz bólu. Upośledzona zostaje także czynność układu oddechowego.
Zależnie od rozległości i nasilenia procesu zapalnego zakres objawów zakażenia wirusowego górnych dróg oddechowych jest szeroki i może obejmować zarówno ostry nieżyt błony śluzowej nosa, jak i ostre zapalenia zatok przynosowych, gardła, migdałków, krtani lub ucha środkowego.
Zmienność obrazu klinicznego wynika ze znacznego zróżnicowania czynników etiologicznych infekcji, wieku chorego i konstrukcji immunologicznej jego organizmu, a także współwystępujących schorzeń przewlekłych i zjadliwości patogenu.
W przebiegu klinicznym ostrego zakażenia górnych dróg oddechowych wyróżnia się trzy fazy, co przedstawiono na rycinie 2.
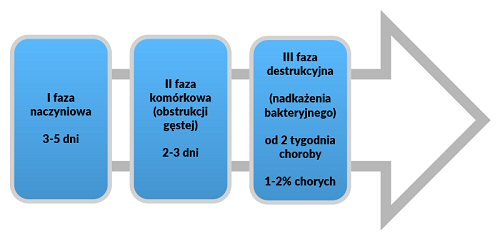
Rycina 2. Przebieg ostrego zakażenia górnych dróg oddechowych [9].
W początkowej fazie zakażenia strategia terapeutyczna ogranicza się do tzw. czujnego wyczekiwania (ang. watchful waiting), uważnej obserwacji stanu chorego z wdrożeniem minimalnego leczenia farmakologicznego w celu złagodzenia objawów i poprawy komfortu pacjenta.
Korzystna jest ekspozycja na chłodne powietrze i stosowanie preparatu zmniejszającego nasilenie surowiczego nieżytu błony śluzowej i blokady nosa. W niektórych przypadkach konieczne może być podanie leku obniżającego gorączkę [10].
Wyzwolone w I fazie choroby cytokiny zapalne i substancje leukotaktyczne prowadzą do zmiany struktury śluzu i powstania nacieku komórkowego.
Podwyższona ciepłota ciała, zwiększona przepuszczalność naczyń krwionośnych i często niewystarczający dowóz płynów w czasie infekcji prowadzą do zagęszczenia i zwiększenia lepkości śluzu w drogach oddechowych.
Towarzyszą temu zmiany struktury śluzu - w warstwie zolowej tworzą się kompleksy białkowo-mukopolisacharydowe, dochodzi także do polimeryzacji mukopolisacharydów. Zmiany te prowadzą do gromadzenia się gęstej, lepkiej wydzieliny w drogach oddechowych, co ułatwia namnażanie się bakterii kolonizujących górne drogi oddechowe.
Najważniejszym postępowaniem leczniczym na tym etapie choroby jest upłynnienie i ewakuacja gęstej wydzieliny zalegającej w drogach oddechowych w celu zmniejszenia ryzyka wystąpienia nadkażenia bakteryjnego (faza III).
Można to osiągnąć przez odpowiednie nawadnianie chorego, nawilżanie powietrza i stosowanie leków mukoaktywnych [11].
U około 1–2% chorych z zakażeniem wirusowym górnych dróg oddechowych dochodzi do nadkażenia bakteryjnego, co skutkuje pogorszeniem się stanu ogólnego i ponownym wzrostem temperatury ciała, a także zwiększeniem ilości i zmianą charakteru wydzieliny odkrztuszanej z dróg oddechowych.
W tej sytuacji po wnikliwym zebraniu wywiadu, przeprowadzeniu badania fizykalnego oraz ustaleniu rozpoznania należy rozważyć racjonalną antybiotykoterapię.
Po pojawieniu się pierwszych objawów infekcji górnych dróg oddechowych chorzy często sami poszukują leków dostępnych bez recepty, zwłaszcza w obecnej sytuacji epidemiologicznej, kiedy z powodu epidemii COVID-19 dostęp do opieki medycznej jest utrudniony.
Popularną grupą preparatów terapeutycznych są leki zawierające substancje naturalne, takie jak jeżówka purpurowa, czarny bez, babka lancetowata, czosnek pospolity, aloes drzewiasty czy tymianek pospolity.
Na rynku są również dostępne wyciągi roślinne z korzenia pelargonii afrykańskiej, liści bluszczu pospolitego oraz zawierające żywotnik zachodni i dzikie indygo.
Niektóre substancje roślinne zaliczane są do immunomodulatorów, co rozumiemy jako korzystną modyfikację odpowiedzi obronnej organizmu.
Immunomodulacja jest procesem złożonym, którego efektem może być zarówno wzmocnienie odpowiedzi immunologicznej, jak i jej supresja [12].
W przypadku zakażeń wirusowych górnych dróg oddechowych pożądane jest wzmocnienie nieswoistej odpowiedzi immunologicznej poprzez ograniczenie przylegania wirusa do nabłonka dróg oddechowych, spowolnienie tempa replikacji wirusa oraz pobudzenie mechanizmów fagocytozy, opsonizacji i endocytozy obcego antygenu.
W skutecznej obronie przeciwwirusowej istotne jest także stymulowanie produkcji i wydzielania interferonów oraz przyspieszenie endocytozy cząstek wirusa przez komórki prezentujące antygen limfocytom, co aktywuje drogę odpowiedzi swoistej.
Pelargonia afrykańska (Pelargonium sidoides) może zarówno zmniejszać przyleganie wirusów i bakterii do nabłonka dróg oddechowych, jak i działać mukoaktywnie. Należy podkreślić, że właściwości terapeutyczne wyciągu z pelargonii afrykańskiej były przedmiotem randomizowanych badań kontrolowanych podaniem placebo prowadzonych zarówno wśród dorosłych, jak i w grupie pacjentów w wieku rozwojowym [13,14].
W 2013 roku opublikowano wyniki badania randomizowanego z udziałem 61 dzieci chorych na astmę oskrzelową, u których wstąpiły objawy infekcji wirusowej górnych dróg oddechowych. Autorzy wykazali, że pięciodniowa kuracja wyciągiem z korzenia pelargonii afrykańskiej istotnie zmniejszała u uczestniczących w badaniu dzieci częstość kaszlu i przekrwienie błony śluzowej nosa.
Ponadto w grupie dzieci otrzymujących wyciąg z pelargonii rzadziej dochodziło do napadów duszności astmatycznej [15]. Z klinicznego punktu widzenia wydaje się, że stosowanie preparatów zawierających wyciąg z korzenia pelargonii afrykańskiej w zapobieganiu zakażeniom wirusowych dróg oddechowych, jak i w terapii wspomagającej może być uzasadnione (I i II faza zapalenia).
Inne substancje pochodzenia roślinnego także wykazują korzystny wpływ na elementy odpowiedzi immunologicznej. Białka arabinogalaktanu (AGP) uzyskane z korzenia dzikiego indygo (Baptisia tinctora) i jeżówki bladej (Echinacea pallida) pobudzają proliferację limfocytów i produkcję IgM oraz wzrost wydzielania IL-6 i azotynów przez makrofagi, co potwierdzono w badaniu z użyciem komórek mysich [16].
W odniesieniu do organizmu ludzkiego wyniki badań dotyczących skuteczności terapeutycznej ekstraktu z jeżówki w terapii infekcji dróg oddechowych u dzieci przedstawione przez Anheyer i wsp. w przeglądzie z metaanalizą są niejednoznaczne [17].
Również inni badacze zauważyli, że wyniki przeprowadzonych dotychczas badań dotyczących skuteczności preparatów jeżówki są sprzeczne i dotyczy to w szczególności pacjentów w wieku rozwojowym [18]. U dorosłych jeżówka może być jednak skuteczna jako leczenie wspomagające choroby przeziębieniowej [19].
Znaczne różnice w metodologii dostępnych badań powodują, że nie dysponujemy obecnie jednoznacznymi dowodami naukowymi na stosowanie preparatów jeżówki w monoterapii, mimo opublikowanych wcześniej prac, potwierdzających ich stymulujący wpływ na makrofagi, komórki NK oraz – w mniejszym stopniu – na liczebność i aktywność limfocytów T i B [20].
Jak wiadomo z codziennej praktyki, niską skuteczność monoterapii możemy poprawić, stosując preparaty złożone z kilku substancji o działaniu synergistycznym. Przykładem jest od lat znany pacjentom i lekarzom Esberitox N, zawierający żywotnik zachodni (Thuya occidentalis), dzikie indygo (Baptisia tinctora) i jeżówkę purpurową (Echinacea purpurea).
Zasadność takiego postępowania terapeutycznego potwierdza opublikowane w 2019 roku wielośrodkowe, otwarte, nierandomizowane i niekontrolowane badanie apteczne, do którego zrekrutowano 955 pacjentów w wieku 12–90 lat. Zdecydowana większość, bo aż 85%, uczestników oceniła skuteczność preparatu jako dobrą lub bardzo dobrą i zadeklarowała zmniejszenie nasilenia objawów chorobowych o co najmniej 50% w 5. dniu leczenia.
Autorzy badania podkreślają również korzystny wpływ wczesnego wdrożenia złożonego preparatu roślinnego (przy pierwszych objawach zakażenia górnych dróg oddechowych) na czas trwania infekcji. Preparat leczniczy był dobrze tolerowany – 98% badanych oceniło tolerancję preparatu jako dobrą lub bardzo dobrą. Odnotowano 34 zdarzenia niepożądane, jednak żadne z nich nie było poważne. Zdaniem autorów badanie jako typowy projekt real-life pozwala na rzeczywistą pozytywną ocenę stosunku korzyści do ryzyka dla terapii tym złożonym preparatem roślinnym [21].
Dobre rezultaty uzyskano także, stosując Esperitox N jako terapię wspomagającą w grupie pacjentów z przewlekłą obturacyjną chorobą płuc (POChP) w leczeniu zaostrzenia choroby.
Wieloośrodkowe, prospektywne, randomizowane badanie kontrolowane podaniem placebo przeprowadzono w grupie 53 dorosłych pacjentów z rozpoznaną wcześniej POChP, którzy otrzymywali antybiotyk makrolidowy przez 28 dni z powodu zaostrzenia przewlekłej choroby obturacyjnej.
Chorych losowo przydzielono do dwóch grup – otrzymujących antybiotyk makrolidowy i Esberitox N lub makrolid i placebo.
Badanie przeprowadzono metodą podwójnie ślepej próby. Po zakończeniu obserwacji stwierdzono, że różnica w wartości podstawowego parametru w ocenie stopnia obturacji drzewa oskrzelowego, czyli natężonej objętości wydechowej pierwszosekundowej (FEV1), między obiema leczonymi grupami wyniosła 267 ml i okazała się istotna statystycznie (p = 0,0499).
Ponadto przyjmowanie Esberitox N jako leczenia wspomagającego antybiotykoterapię preparatem makrolidowym wyraźnie korzystnie wpływało na szybkość uzyskanej poprawy klinicznej (5,7 dnia do uzyskania połowy maksymalnej poprawy klinicznej w grupie Esberitox N vs 12,8 dnia w grupie placebo). Warto podkreślić, że terapia była dobrze tolerowana [22].
Bezpieczeństwo pacjenta zawsze powinno być priorytetem, zatem warto podkreślić, że są sytuacje kliniczne, w których stosowanie substancji immunostymulujących jest przeciwwskazane.
Należą do nich: pierwotne i wtórne niedobory odporności, choroby autoimmunizacyjne, czynna gruźlica, choroby reumatyczne, choroby układowe tkanki łącznej, nowotwory, ostre choroby zakaźne, schorzenia przebiegające z niewydolnością oddechowo-krążeniową oraz ciąża [23].
W każdym przypadku obowiązuje indywidualizacja postępowania terapeutycznego i edukacja pacjenta.
.
Post został pochwalony 0 razy
Ostatnio zmieniony przez admin dnia Nie 10:34, 05 Gru 2021, w całości zmieniany 3 razy
|
|
| Powrót do góry |
|
 |
|
|
 |
| Zobacz poprzedni temat :: Zobacz następny temat |
| Autor |
Wiadomość |
admin
Administrator
Dołączył: 23 Kwi 2006
Posty: 299
Przeczytał: 0 tematów
Pomógł: 5 razy
Ostrzeżeń: 0/3
|
 Wysłany: Wto 12:03, 10 Lis 2020 Temat postu: Wysłany: Wto 12:03, 10 Lis 2020 Temat postu: |
|
|
Piśmiennictwo:
1. Janus D. Wpływ pogody na zdrowie człowieka. Lek Wojsk. 2005; 81(1):46–49.
2. Welliver RC. Temperature, humidity, and ultraviolet B radiation predict community respiratory syncytial virus activity. Pediatr Infect Dis J. 2007; 26(Suppl. 1):29–35.
3. Zawadzka-Gralec A., Czerwionka-Szaflarska M.: Czynniki atmosferyczne a choroby układu oddechowego u dzieci i młodzieży. Pediatr Pol. 2008; 83:464–471.
4. Dzierżanowska D., Dzierżanowska-Fangrat K.: Przewodnik antybiotykoterapii. Α-medica Press 2015.
5. Stobnicka A., Górny R. Wirusy jako szkodliwe czynniki biologiczne w środowisku pracy biurowej. Bezpieczeństwo pracy. 2017; 4:12–15.
6. Szczukocka-Zych A., Makowska M. Profilaktyka i leczenie nawracających infekcji górnych dróg oddechowych u dzieci. Pediatr Dypl. 2018; 22(4).
7. Działo J., Niedźwiecka-Rystwej P.,Mękal A.,Deptuła W. Charakterystyka tkanki limfatycznej błon śluzowych przewodu pokarmowego i układu oddechowego. Alergia Astma Immunologia. 2010; 15(4):197–202.
8. Śliwa-Dominiak J., Tokarz-Deptuła B., Deptuła W. Rola komórek układu odpornościowego i ich receptory w zakażeniach wirusowych – wybrane dane. Post Hig Med Dosw (online). 2014; 68:404–409.
9. Radzikowski A, Albrecht P. Leczenie objawowe zakażeń dróg oddechowych – podstawy patofizjologiczne i strategia postępowania. Pediatr Pol. 1998; 73:1–8.
10. Albrecht P., Radzikowski A.: Optymalizacja antybiotykoterapii zakażeń dróg oddechowych w aspekcie programu ochrony antybiotyków. Nowa Medycyna. 2009; 1:13–20.
11. Car H.: Leki mukoaktywne - różnice działania. Klinika Nowa. 2010; 4:447-451
12. Webster NR., Galley HF. Immunomodulation in the critically ill. British Journal of Anaesthesia. 2009; 103(1):70–81.
13. Timmer A, Günther J, Motschall E, et al. Pelargonium sidoides extract for treating acute respiratory tract infections. Cochrane Database Syst Rev. 2013; (10):CD006323.
14. Kolodziej H, Kayser O, Radtke OA i wsp. Pharmacological profile of extracts of Pelargonium sidoides and their constituents. Phytomed. 2003; 10 Suppl. 4:18–24.
15. Tahan F., Melih Y. Can the Pelargonium sidoides root extract EPs® 7630 prevent asthma attacks during viral infections of the upper respiratory tract in children? Phytomedicine. 2013; 20(2):148–150.
16. Classen B, Thude S, Blaschek W, Wack M, Bodinet C. Immunomodulatory effects of arabinogalactan-proteins from Baptisia and Echinacea. Phytomedicine. 2006; 13(9–10):688–694.
17. Anheyer D, Holger C, Romy L, et al. Herbal medicine in children with respiratory tract infection: systematic review and meta-analysis. Acad Ped. 2018;18(1):8–19.
18. Linde K, Barrett B, Wölkart K et al.: Echinacea for preventing and treating the common cold. Cochrane Database Syst Rev. 2006; (1):CD000530.
19. Szczukocka-Zych A., Bozio M.,Feleszko W. Immunostymulacja jako metoda ograniczenia niepotrzebnej antybiotykoterapii. Pediatr Med Rodz. 2015; 11(4):365–373.
20. Barret B. Medical properties of Echinacea: A crtitical review. Phytomedicine. 2003; 10(1):66–86.
21. Henneicke-von Zepelin HH, Nicken P, Naser B, Kuchernig JC, Brien N, Holtdirk A, Schnitker J, Nolte KU. Non-interventional observational study broadens positive benefit-risk assessment of an immunomodulating herbal remedy in the common cold. Curr Med Res Opin. 2019; 35(10):1711–1719.
22. Hauke W., Köhler G., Henneicke-von Zepelin H.-H.., Freudenstein J. Esberitox N as supportive therapy when providing standard antibiotic treatment in subjects with a severe bacterial infection (acute exacerbation of chronic bronchitis). A multicentric, prospective, double-blind, placebo-controlled study. Chemotherapy. 2002; 48:259–266.
23. Bernatowska E, Feleszko W. i wsp. Immunomodulacja w wieku rozwojowym w praktyce lekarza podstawowej opieki zdrowotnej – fakty i mity. Pediatr Dypl. 2013; 17(1):27–37.
[link widoczny dla zalogowanych]
.
Post został pochwalony 0 razy
Ostatnio zmieniony przez admin dnia Nie 10:34, 05 Gru 2021, w całości zmieniany 2 razy
|
|
| Powrót do góry |
|
 |
|
|
Możesz pisać nowe tematy
Możesz odpowiadać w tematach
Nie możesz zmieniać swoich postów
Nie możesz usuwać swoich postów
Nie możesz głosować w ankietach
|
fora.pl - załóż własne forum dyskusyjne za darmo
Powered by phpBB © 2001, 2005 phpBB Group
|





